Que sont les Exosomes ?
Les exosomes sont des vésicules extracellulaires qui contiennent plusieurs composants cellulaires, notamment des protéines, de l’ADN et de l’ARN. La fusion de la membrane plasmique avec des corps multivésiculaires (MVB) produit des exosomes (Figure 1). Ces vésicules sont principalement libérées par une cellule pour communiquer ou interagir avec les cellules voisines en délivrant des informations au sein de l’ADN et de plusieurs types d’ARN, par exemple, microARN, ARNm. De plus, la protéine contenue dans les exosomes peut interagir avec le processus cellulaire de la cellule réceptrice. Par conséquent, il est important d’identifier les informations au sein de l’exosome pour étudier le processus cellulaire. En particulier, la caractérisation de l’exosome devient une bonne technique pour étudier le cancer métastatique (Zhu et al., 2020). Leurs biomarqueurs spécifiques aux cellules dont ils sont issus peuvent également être utiles à des fins de diagnostic (McNicholas et al., 2017).
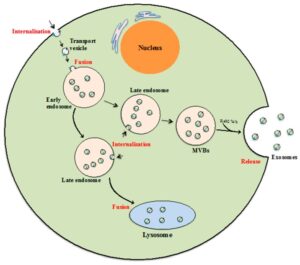
Figure 1 : Formation d’exosomes dans la cellule (Than, Guanzon, Leavesley et Parker, 2017).
Plusieurs méthodes peuvent être utilisées pour séparer l’exosome d’un fluide corporel (Figure 2), tandis que la plupart des méthodes de séparation des exosomes sont basées sur la technique d’ultra-centrifugation (UC) (Brennan et al., 2020). Certaines des méthodes d’isolement d’exosome sont résumées ici :
Isolation basée sur l’ultracentrifugation : les exosomes peuvent être séparés par une série de techniques de centrifugation, en éliminant les composants inutiles tels que les cellules et les débris cellulaires. Ces centrifugations fourniront un surnageant d’exosomes. Enfin, l’ultracentrifugation fournira un culot d’exosomes. Mais il est très important de laver les exosomes granulés avec des milieux de culture cellulaire ou du PBS au moins une fois pour les purifier. Il est également important d’effectuer toutes les étapes de centrifugation à 4°C afin de maintenir les protéases, DNases et RNases inactives.
Ultracentrifugation avec des gradients de densité de saccharose : Pour cette technique, le culot d’exosome sera ensuite centrifugé à 100 000–200 000 x G pendant 120 min dans un milieu à gradient de saccharose. Les exosomes devraient flotter à des densités de saccharose allant de 1,15 à 1,19 g/mL sur des gradients continus de saccharose. Bien que cette méthode fournisse un exosome hautement purifié, elle prend du temps et demande beaucoup de travail. De plus, la configuration de la vitesse et du temps de centrifugation nécessite des personnels très expérimentés.
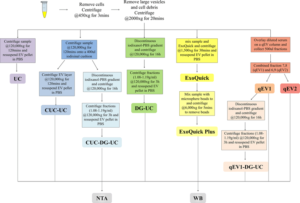
Figure 2 : Résumé schématique de l’isolement des exosomes à l’aide de cinq méthodes différentes à partir de sérum humain et d’analyses en aval. Avec Western blot (WB) ou analyse de suivi des nanoparticules (NTA) (Brennan et al., 2020).
Ultracentrifugation en coussin (CUC) : l’échantillon de sérum doit être dilué dans 4,6 ml de PBS et 0,4 ml de 40 % d’iodixanol-PBS pour une ultracentrifugation à 120 000 g pendant 2 heures à 4 °C. Après centrifugations, le culot d’exosome nécessite une remise en suspension dans 50 à 100 µl de PBS résiduel pour CUC.
Isolation basée sur la chromatographie d’exclusion de taille (SEC) : il s’agit d’une méthode d’ultrafiltration plus rapide que l’ultracentrifugation, bien que les exosomes puissent s’agréger et obstruer les pores du gel, ce qui entraîne un faible rendement. En outre, la contamination par l’ARN non exosomal est également un problème pour l’utilisation de cette technique. Par conséquent, il nécessite une étape de lavage après chaque étape de filtration pour améliorer la récupération des exosomes. Un concentrateur de nanofiltration pourrait être utile pour un enrichissement rapide des exosomes avec de courtes périodes de centrifugation (Ludwig, Razzo, Yerneni et Whiteside, 2019).
Isolation basée sur la précipitation : les exosomes peuvent facilement précipiter dans plusieurs solutions de polymères excluant le volume, par exemple le polyéthylène glycol. Si l’échantillon incube pendant la nuit avec du polyéthylène glycol à 4 ° C, la centrifugation à basse vitesse fournit un culot d’exosome. De plus, les lectines pourraient être utiles pour agglutiner les exosomes et les agglomérer à une vitesse centrifuge relativement faible (Chang, Chang, Chao et Yu, 2018).
Isolement basé sur l’immuno-affinité : les exosomes contiennent un grand nombre de protéines, y compris des récepteurs cellulaires à leur surface. Cela leur permet de se lier avec des anticorps spécifiques à leurs aptamères. Des anticorps spécifiques aux marqueurs de protéines exosomales, tels que Hsp70, CD9, CD63, CD81, CD82, Rab-5b et TSG101 sont utilisés pour cette technique pour sélectionner l’exosome souhaité ou pour piéger l’exosome indésirable. Après piégeage de l’exosome avec un anticorps anti-marqueur spécifique, ces anticorps peuvent s’immobiliser sur des plaques ELISA, des billes magnétiques et de chromatographie (Cai et al., 2018), ou les utiliser dans des dispositifs microfluidiques.
En utilisant l’immunopartialité basée sur des billes magnétiques, ces sous-ensembles peuvent être spécifiquement capturés et examinés à l’aide de la cytométrie en flux ou éventuellement de la microscopie électronique. Pour que les exosomes servent de marqueur, les vésicules doivent être améliorées et spécialement fractionnées. Amélioration des exosomes en grande partie réalisée par ultracentrifugation et régulièrement en mélange avec l’inclinaison de l’épaisseur du saccharose. Il sépare les sous-populations d’exosomes si elles sont présentes. Les protéines CD9 et CD81 sont des marqueurs extracellulaires normaux qui peuvent être utilisés pour des captures spécifiques. Les billes de latex pour une capture spécifique nécessitent plusieurs étapes de centrifugation, ce qui pose un défi. Les billes magnétiques de taille nanométrique sont une alternative aux billes de latex pour la capture des exosomes, détachant une population plus homogène de vésicules concernant